Anvisa simplifica processo para acesso ao canabidiol
Anvisa simplifica processo para compra de produtos à base de canabidiol. Regras foram publicadas nesta sexta-feira. A documentação para adquirir os medicamentos deve ser de um ano.
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou nesta sexta-feira (19/12) um passo a passo com o novo procedimento para solicitar a autorização de importação excepcional de produtos à base de Canabidiol (CBD), uma das substâncias derivadas da maconha.
O órgão decidiu simplificar os trâmites e, a partir de agora, a documentação terá validade de um ano, sendo necessária apenas a apresentação da receita médica a cada novo pedido. A informação foi passada às famílias de pacientes que usam a substância como tratamento terapêutico.
Alguns representantes desses pacientes fizeram ontem um ato público em frente à agência pedindo a liberação da substância.
Pessoas de diferentes cidades do Brasil reivindicaram e cobraram um posicionamento da Anvisa.
A reclassificação do CBD, de proibida para controlada, seria analisada ontem, na última reunião do ano da diretoria do órgão, mas foi adiada mais uma vez. Desde maio, quando um diretor pediu vista do processo, as famílias aguardam um posicionamento. Agora, de acordo com a Anvisa, as conversas serão retomadas na primeira quinzena de janeiro.
“Quando soubemos do cancelamento da reunião foi um sentimento de tristeza muito grande para todos nós. Então, enviamos uma mensagem pedindo o encontro e fomos atendidos. Foi uma oportunidade de conversarmos e tirarmos nossas dúvidas. Eles nos informaram sobre a simplificação do processo e nos confirmaram que o assunto entraria na pauta em janeiro.
Foi um alívio e um presente de Natal que recebemos”, comentou Norberto Fischer, 46 anos, pai de Anny Fischer, 6 anos.
A menina tem uma síndrome rara e usa o CBD para tratar as crises convulsivas de difícil controle.
A reunião da diretoria do órgão que aconteceria ontem foi adiada, segundo a assessoria de comunicação da Anvisa, devido a uma incompatibilidade da agenda dos diretores. Mas, o diretor-presidente substituto, Jaime Cesar de Moura Oliveira, e o diretor relator do processo, Renato Porto, estiveram no local e se encontraram com as famílias.
Apesar de ser proibido, a Anvisa recebe e autoriza pedidos excepcionais da substância para casos como o de Anny. Já houve 338 solicitações feitas à agência, das quais 283 autorizadas, inclusive um pedido de um plano de saúde. Devido à pressão de alguns setores da sociedade, o órgão decidiu facilitar a importação da substância.
Com a publicação das novas regras, a partir desta sexta, os documentos apresentados no momento do pedido, valerão por um ano. A cada nova solicitação de importação, será necessário apresentar apenas a receita médica. No primeiro pedido, além da prescrição, médico e paciente deverão assinar um termo de responsabilidade e outros dados gerais.
O passo a passo para a solicitação ficará disponível no site da agência.
Entenda a resolução do CFM que autoriza médicos a prescreverem o canabidiol
Resolução CFM nº 2.113/2014 detalha os critérios para emprego do CBD com fins terapêuticos no Brasil.
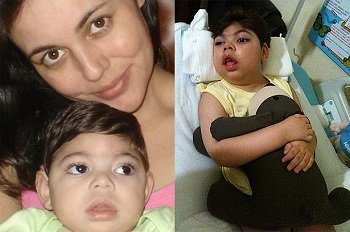
Das 70 crises convulsivas diárias que acometiam o corpo de João Gabriel de Oliveira Vidal (foto ao lado), de 7 anos, o uso do canabidiol (CBD), substância derivada da maconha, conseguiu reduzir para 15.
O mineirinho de Uberlândia conseguiu recentemente na Justiça que o governo de Minas bancasse o tratamento durante um ano (Saiba mais aqui) e a expectativa é que em dois meses ele já receba a medicação.
Enquanto isso, ele tem usado o conteúdo de duas injeções contrabandeadas dos Estados Unidos pela internet ao preço de R$ 1500 cada (foto abaixo).
Graduada em comércio exterior, Kerlin de Oliveira Marques Vidal, 36 anos, não exerce a profissão desde que João nasceu. A criança precisa de cuidados 24 horas e também foi na Justiça que conseguiu o direito a um home care.
O garotinho teve parada cardiorrespiratória ainda na barriga da mãe, durante o trabalho de parto, e ficou com graves sequelas: ele não fala, não anda, não enxerga e não deglute a própria saliva.
“Para a medicina ele é considerado um vegetal”, afirma Kerlin.
Apesar do peso da frase, não são todos os profissionais de saúde que pensam dessa forma.
Tanto é que a família, depois de tanto lutar para conseguir a prescrição do CBD, encontrou-se com o neuropediatra João Paulo Porto, que antes de o Conselho Federal de Medicina aprovar a prescrição da substância por médicos brasileiros, já tinha colocado nas mãos de Kerlin o documento que ela precisava para dar entrada com o pedido na Agência Nacional de Vigilância Sanitária (Anvisa).
A Resolução CFM nº 2.113/2014 publicada nesta sexta-feira (19/12) no Diário Oficial da União enche de esperança famílias brasileiras que lutam para conseguir o medicamento à base de CBD. No entanto, os adultos ficam de fora e o tetrahidrocanabinol (THC) também.
Isso por que a resolução permite o uso do canabidiol somente para crianças e adolescentes até a idade de 18 anos que sofram com crises de epilepsias refratárias e nos casos em que outros medicamentos não fazem efeito.
A Agência Nacional de Vigilância Sanitária (Anvisa) afirma que “a decisão do CFM não altera os mecanismos criados pela agência para dar acesso ao medicamento, inclusive porque a prescrição é um dos critérios para a importação excepcional do produto.
A ação do CFM vem ao encontro e endossa o profissional que assumia a responsabilidade de prescrever a substância (Canadibiol e/ou THC ) sem qualquer respaldo do Conselho”.
João Gabriel sofre de encefalopatia hipóxica isquêmica grau 3, ou seja, o mais severo. Por causa da doença, falta oxigenação no cérebro dele, o que acarreta as crises convulsivas refratárias (de difícil controle). “Nada controlava, nada cessava”, conta Kerlin.
Segundo ela, todos os remédios aprovados pela Anvisa foram tentados e nenhum mudou o quadro de saúde de João.
Por essa razão, ela entrou em contato com Katiele Fischer (foto ao lado), mãe de Anny Fischer, 6 anos, que sofre de problema genético raro, e foi a primeira a contrabandear o CBD para o Brasil. A notícia da família de Brasília é referência para todas as outras que desejam tratar seus filhos com a substância derivada da maconha.
E foi a experiência de Katiele que ajudou Kerlin a administrar a dosagem do medicamento para o filho.
“Usei a tabela da Anny como referência para o João.
Ele começou com 2ml.
A cada dez dias, aumento a dose que, atualmente é de 10ml”, afirma a mãe do garotinho.
Kerlin conta que enquanto tentava conseguir o medicamento pelas vias legais, fez uma ‘vaquinha’ para conseguir importar as ampolas de CBD.
A expectativa de Kerlin é que, com o aumento da dose, as crises zerem e João Gabriel, que faz acompanhamento com fisioterapeuta e fonoaudióloga, tenha cada vez mais qualidade de vida. “Antes do CBD, qualquer estímulo que João recebia era uma crise convulsiva. A fisioterapeuta levantava a mão dele, uma crise, mexia na perna, outra crise.
Hoje isso não existe mais”, explica.
Kerlin recebeu com alegria a decisão do CFM, mas garante que a luta não terminou: “queremos o CDB na lista de remédios da Anvisa”.
Entenda a resolução
Além de restringir a prescrição para aos médicos da área de neurologia, neurocirurgia e psiquiatria, a resolução do CFM também dispõe da dosagem e outros detalhes. Veja:
Resolução do CFM para prescrição do canabidiol é criticada por famílias e pacientes
A substância derivada da maconha teve uso restrito com a normativa e deixou os adultos de fora.
O filho do mastologista mineiro Leandro Ramires está entre os pacientes autorizados pelo Conselho Federal de Medicina a usar o canabidiol, conforme a Resolução nº 2.113/2014, publicada sexta-feira (19/12) e que entra em vigor a partir da publicação no Diário da União. Mas o médico não vê motivo para comemorar.
“Uma decisão que parece muita boa prejudicou enormemente os adultos, que não vão encontrar médicos que prescrevam os medicamentos para tratar doenças altamente graves”, avalia o coordenador do serviço de mastologia do Hospital das Clínicas da Universidade Federal de Minas Gerais (UFMG).
É que a resolução permite o uso do canabidiol somente para crianças e adolescentes até a idade de 18 anos que sofram com crises de epilepsias refratárias a tratamentos convencionais, nos casos em que outros medicamentos não fazem efeito.
Desde março, Ramires importa dos Estados Unidos uma ampola de US$ 499 que dura apenas um mês. O remédio à base de canabidiol é usado para o tratamento de Benício, de 6 anos, diagnosticado com síndrome de Dravet, que causa crises convulsivas graves e incuráveis. Com a nova terapia, o menino começou a falar e deixou de tomar nove medicamentos.
Por prescrever maconha medicinal para adultos, o mastologista se sente agora limitado pelo CFM, já que outro ponto da resolução determina que somente médicos da área de neurologia podem receitar o CBD.
Mas ele diz que esta decisão não o impedirá de ajudar quem precisa, já que as prescrições estão embasadas judicialmente.
Leandro e outros mineiros que lutam pela causa vão ao Rio de Janeiro participar da fundação de uma associação brasileira de pacientes que fazem uso da maconha para tratar doenças graves. O primeiro passo será entrar na Justiça para reivindicar o direito de uso irrestrito do canabidiol. “Não queremos usar de maneira escondida.
Temos nome, CPF e endereço”, diz o mastologista.
Vitória sem prêmio
A bomba de morfina e a bolsa de remédios deixaram de fazer parte da vida da universitária Juliana Paolinelli Novaes (foto ao lado), de 35 anos, graças à maconha.
Diagnosticada na adolescência com a síndrome da cauda equina, que provoca o esmagamento da medula e consequentes sequelas no sistema nervoso periférico, ela sofria com fortes dores.
“Quando descobri o potencial da maconha, fiquei maravilhada, porque já tinha passado por todos os medicamentos possíveis e imagináveis para epilepsia e vivia internada.
Nesse meio tempo até engravidei”, conta a mãe de duas filhas.
Juliana é a primeira paciente no Brasil a conseguir autorização judicial, com validade de um ano, para importar o medicamento Sativex, feito à base de substâncias derivadas da maconha. O remédio, proibido no Brasil, contém o Tetrahidrocanabinol (THC).
Apesar da vitória, conquistada em agosto, por meio de liminar, até agora ela não conseguiu ter acesso ao medicamento.
É preciso ter uma receita médica do país de onde ele será comprado.
Enquanto isso, Juliana fuma maconha, fornecida por um grupo de cultivadores, para conter as crises diárias de espasmos.
“É no mínimo uma covardia essa decisão do CFM de beneficiar apenas crianças e adolescentes.
Por que só uma pequena parcela vai ter direito de se tratar? O ideal seria prescrever para todos os pacientes que têm necessidade, sem distinção de idade”, opina.
Depois que começar a usar o medicamento a que tem direito, Juliana espera ter uma reversão do quadro inflamatório e diminuir o número e a intensidade das crises.

Ela aprendeu a cuidar da filha, uma criança especial com retardo mental e epilepsia de difícil controle.
Mas a menina precisou aprender a socorrer a mãe: a dona de casa também sofre com as crises convulsivas.
“Tive que ensiná-la a agir quando eu estiver tendo algo.
Percebo que a Sabrina tem medo, mas já me ajudou até a levantar quando caí da cama”, relatou Patrícia.
Sabrina saiu da escola, onde já tinha um horário reduzido e Patrícia nunca conseguiu permanecer em um emprego, por conta das constantes crises.
Das vezes em que a mãe buscou uma prescrição médica de neurologistas, ela esbarrou em burocracias e proibições.
E, pelo jeito, continuará esbarrando.
A filha, pelo menos, terá chance.
Pesquisas limitadas
Na avaliação do vice-presidente do Conselho Federal de Medicina (CFM), Emmanuel Fortes Silveira, toda substância colocada no mercado tem indicação, contra-indicação e efeitos colaterais. “Não é isso que define o valor e propriedade do uso de um remédio para a sociedade, é o benefício.
Neste caso, precisamos estabelecer como a substância funciona dentro de parâmetros científicos e de maneira segura.
”.
O CBD, além de ser permitido apenas para crianças e adolescentes, só pode ser prescrito por médicos da neurologia e áreas de atuação correlatas, com neurocirurgia e psiquiatria. O conselho alerta que os especialistas devem informar ao paciente e familiares os problemas e benefícios potenciais do tratamento.
E, para ser submetida aos cuidados, a pessoa deve preencher critérios de indicação e contraindicação, para garantir as doses certas da substância.
A seleção levará em conta a resistência da criança ou do adolescente a tratamentos convencionais.
A resolução estabelece como dose mínima, por via oral, de 2,5 mg por quilo, divididas em duas vezes ao dia. Mas, o médico pode ajustar a recomendação de acordo com cada caso. O CFM criou um sistema de controle on-line para registrar médicos e pacientes a fim de monitorar o tratamento e a evolução do quadro.
Todos esses critérios e padrões foram tomados, porque, na avaliação do CFM, as pesquisas permitem chegar até este ponto. “Não temos elementos científicos que possam indicar a aprovação da maconha para outros fins”, afirmou o presidente da instituição, Carlos Vital Tavares.
Para a Academia Brasileira de Neurologia (ABN), embora não tenha um efeito “milagroso” para o tratamento de todas as formas de epilepsia, o canabidiol “poderá ter papel importante no tratamento de epilepsias muito difíceis, em casos específicos, ainda não definidos cientificamente”.
O CFM e a ABN fazem ressalvas, dizendo que “não há evidências científicas que comprovem que os canabinóides são totalmente seguros”.
Família pioneira também critica
A decisão de liberar que médicos receitem a substância aconteceu após pedido da Agência de Vigilância Sanitária (Anvisa), que, desde abril deste ano, já autorizou 238 importações de canabidiol.
A primeira delas aconteceu após decisão judicial a pedido da família de Anny Fischer, uma menina de seis anos que sofre de epilepsia e só conseguiu interromper a série de convulsões diárias após iniciar tratamento de canabidiol, há pouco mais de um ano.
A história de Anny é contada no documentário Ilegal, lançado em outubro.
O pai da menina, Norberto Fischer, de 46, acompanhou a resolução do Conselho Federal de Medicina e, embora reconheça um avanço, critica algumas restrições.
“Uma das coisas que foram ditas é que você só pode testar o canabidiol depois de todas as outras opções.
Isso significa que eu tenho que dar para a minha filha um medicamento que causa cegueira, um medicamento que causa atraso neuromotor e, se nada der certo, aí, sim, eu vou poder usar o canabidiol? Eu acho isso um atraso, um retrocesso.
Para ele, a resolução poderia ter avançado em relação a outros canabinóides, como o THC, também derivado da maconha, e não apenas ao canabidiol. “A resolução é um avanço, mas quando olhamos aquilo que foi apresentado, temos um sentimento de retrocesso.
Eles estão restringindo os médicos que podem prescrever a Cannabis, e os pacientes que poderão utilizá-la”, disse.
O caso da menina Anny provocou ainda uma ação civil do Ministério Público Federal do Distrito Federal pedindo a permissão do uso medicinal e científico da Cannabis no Brasil.
No fim de outubro, a Comissão de Constituição e Justiça (CCJ) do Senado também aprovou a importação legal de produtos derivados de maconha para uso medicinal, mas a pauta ainda precisa passar pelo crivo de outras comissões e de votação plenária.
Desde a autorização da Justiça, a Anvisa vinha autorizando a importação da substância, mas exigia que os pacientes apresentassem laudo e prescrição médica. A Anvisa discute agora a decisão de tirar o canabidiol da lista de substâncias proibidas no país, mas ainda não há previsão para que isso ocorra.
Esse seria um primeiro passo para que medicamentos com o canabidiol possam ser produzidos e comercializados no País.
Conselho Federal de Medicina libera médicos para prescreverem remédios à base de maconha
O Conselho Federal de Medicina (CFM) lançou no dia 11/12 uma normativa que libera médicos para prescreverem remédios à base da maconha no Brasil.
Antes da regra, os profissionais que receitavam o canadibiol (CBD), substâncias derivadas da cannabis sativa, ficavam, do ponto de vista ético, em situação de vulnerabilidade já que ainda não há certeza científica dos benefícios da medicação a longo prazo.
A expectativa do CFM é que, com a norma editada, não apenas os especialistas ficarão mais seguros para indicar o tratamento, mas também os pacientes terão mais conhecimento do que estão tomando.
A medida se baseia em estudos que têm demonstrado o potencial dessas substâncias em diminuir a frequência de crises convulsivas entre pacientes com doenças neurológicas graves, para os quais o uso de medicamentos convencionais mostraram pouca eficiência.
Além dos critérios e restrições do uso medicinal da maconha, o CFM vai detalhar quais são os profissionais que vão poder fazer a prescrição do CBD e os pacientes que terão acesso ao composto. Também serão anunciadas as dosagens recomendadas, além das formas de monitoramento dos resultados.
A resolução que trata do assunto e foi aprovada pelo plenário do CFM será encaminhada para o Diário Oficial da União e entrará em vigor após sua publicação. O Conselho também acredita que a norma vai facilitar a entrada do medicamento no Brasil e que poderá influenciar a decisão da Anvisa em liberar as drogas no país.
Posição da Anvisa
Em nota, a Agência Nacional de Vigilância Sanitária (Anvisa) afirma que a decisão do CFM “não altera os mecanismos criados pela Anvisa para dar acesso ao medicamento, inclusive porque a prescrição é um dos critérios para a importação excepcional do produto.
A ação do CFM vem ao encontro e endossa o profissional que assumia a responsabilidade de prescrever a substância proscrita (Canadibiol e/ou THC ) sem qualquer respaldo do Conselho”.
A agência diz ainda que as liberações do medicamento em caráter excepcional vêm ocorrendo: “A Anvisa pretende garantir que, nos casos em que há necessidade do uso de produtos à base de CBD – desde que reconhecidos e prescritos por profissionais da área médica – os pacientes sejam devidamente atendidos.
Assim, o acesso ao Canabidiol pelas pessoas que necessitam deste produto está garantido”.
Como solicitar
Para solicitar à Anvisa a autorização excepcional para a importação de produto à base de Canabidiol, o solicitante deve preencher um formulário específico e juntar as seguintes documentações: laudo médico, prescrição e termo de responsabilidade/esclarecimento. Os modelos destas documentações e as orientações estão disponíveis no site da Anvisa.
Balanço
A Anvisa já recebeu 309 pedidos de excepcionalidade até o dia 10 de dezembro de 2014: 262 foram autorizados, 25 aguardam o cumprimento de exigência pelos interessados, cinco estão em análise pela área técnica e 10 estão em tramitação para autorização.
Ocorreram, ainda, as três primeiras ações judiciais (que deixaram de ser computadas) e cinco arquivamentos de processos: por interesse da família ou casos de falecimento de paciente logo após a entrada do pedido na Agência.
O prazo médio das liberações pela Anvisa é de uma semana.
A diferença entre canabidiol, óleo de cânhamo e maconha inalada
As formas de administração da cannabis medicinal variam de acordo com a doença, o paciente e o efeito terapêutico buscado. Relatos de 2700 a. descrevem o cultivo e uso da Cannabis sativa, a maconha, como analgésico e ansiolítico na China.
No final do século 19, cigarros da planta e extrato líquido eram vendidos em farmácia – indicados, por exemplo, para induzir ao sono e controlar a bronquite crônica.
Depois de décadas de proibição da cannabise e seus derivados ao longo do século 20, estados americanos e alguns países começaram a liberar o uso médico da planta.
Nesses locais, a prescrição médica é baseada no equilíbrio das proporções de dois fitocanabinoides (que são os componentes que interagem com o sistema endocanabinoide do cérebro) principais: tetrahidrocanabidiol (THC) e canabidiol (CBD).
Ou seja, variedades padronizadas da planta são receitadas de acordo com a maior ou menor porcentagem desses canabinoides.
Na Holanda, por exemplo, a variedade Bediol (6% de THC e 7,5% de CBD), produzida de forma padronizada e distribuída em farmácias pela companhia Bedrocan, é indicada para alívio da dor e combate a processos inflamatórios.
Seu uso não causa as alterações mentais características da maconha recreativa porque a proporção mais alta de CBD (que tem propriedades antipsicóticas e ansiolíticas) ameniza a ação do THC, responsável pelos efeitos psicoativos – confusão mental, euforia, fluidez de pensamentos e outras que variam de pessoa para pessoa.
Assim, é possível se beneficiar das qualidades terapêuticas do CBD e do THC (componente que tem efeitos comprovados no controle de dores) sem sofrer alterações psíquicas como efeito colateral.
Nesse caso, a administração é feita por inalação, com o uso de um vaporizador, por exemplo. Como explica o neurocientista Sidarta Ribeiro, diretor do Instituto do Cérebro da Universidade Federal do Rio Grande do Norte (UFRN), é possível usar a maconha como fitoterápico desde que se tenha conhecimento da proporção de canabinoides.
“No caso da inalação com vaporizadores, é possível ter muito controle da dose.
Os efeitos são imediatos e o médico pode administrar doses bem pequenas, medidas com precisão, até atingir o efeito desejado”.
Maconha ou cânhamo?
O termo “cânhamo” (em inglês hemp) refere-se ao caule da planta. Tem menos THC e mais CBD em comparação com as flores e folhas (as inflorescências, chamadas de maconha).
Nos Estados Unidos, o óleo de cânhamo é considerado um suplemento alimentar pelo Food and Drug Administration (FDA), órgão regulador de alimentos e medicamentos, e é comercializado por algumas empresas no país.
Mais recentemente, famílias brasileiras começaram a importar ilegalmente (ou depois de conseguir autorização específica da Anvisa para o seu caso) essa formulação por causa de sua alta proporção de canabidiol (cerca de 20%, contra menos de 1% de THC) – que, além das propriedades já descritas, é um poderoso anticonvulsivante.
Por isso óleos de cannabis com altas quantidades de CBD têm tido resultados surpreendentes – ainda sem comprovação científica em laboratório – o controle de convulsões em crianças com epilepsias graves e difíceis de tratar com remédios disponíveis no mercado. Nesse caso, o óleo é pingado diretamente na boca algumas vezes ao dia.
No Brasil, isto é feito sem prescrição médica, pois qualquer derivado da maconha é proibido.
Os pais que estão tentando esse tratamento o fazem por conta e risco – recorrem aos suplementos, óbvio, por causa da gravidade da doença: há crianças que sofrem centenas de convulsões por dia, o risco de morte é real.
Eles relatam melhoras evidentes no controle das convulsões e desenvolvimento das crianças.
O extrato de canabidiol purificado está em pesquisa clínica. Patenteado pela companhia GW Pharmaceuticals, possivelmente será registrado como medicamento e colocado no mercado, com o nome Epidiolex, em alguns anos.
Logo, as formulações que estão sendo usadas atualmente para o tratamento de epilepsias não são canabidiol isolado, apesar de serem chamadas assim.
São feitas de variedades de maconha ricas em canabidiol ou de partes específicas da planta com mais CBD.
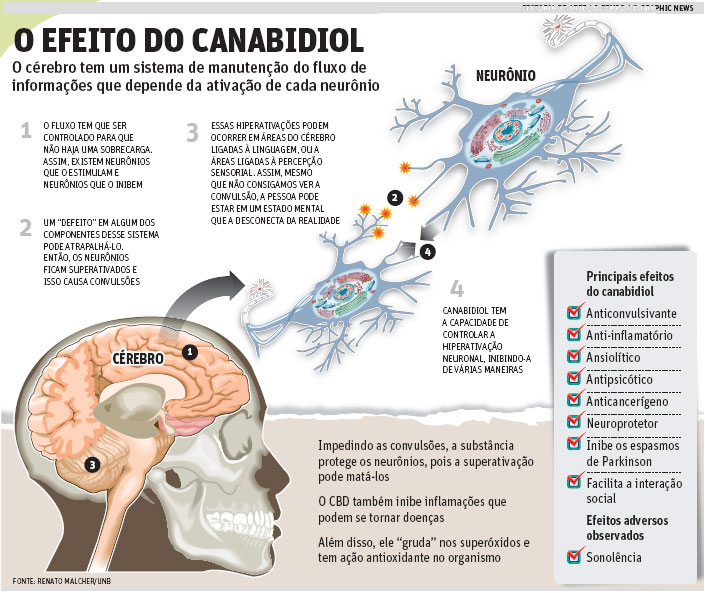
“Tem havido uma grande confusão sobre isso, porque os casos que estão vindo à tona não são de pessoas usando CBD.
São de pessoas que usaram óleo total de uma variedade com alta concentração de CBD e baixa de THC”, diz o neurocientista Renato Malcher-Lopes, professor da Universidade de Brasília (UNB).
Os primeiros casos de tratamento de epilepsia em crianças com uma variedade cannabis rica em CBD ocorreram no estado no Colorado, nos Estados Unidos. A variedade, conhecida como Charlotte’s web, é resultante de cruzamentos genéticos feitos por produtores da planta.
Desde então passou a ser receitada, em extrato, no estado, onde a cannabis é liberada.
“Não há nenhum problema real nisto, apenas o desejo que alguns têm de fazer parecer que o valor medicinal depende da aprovação de intermediários, de indústrias ou de pessoas que possuem patentes sobre princípios e métodos de isolamento”, diz Malcher-Lopes.
Vale lembrar que o uso medicinal seguro de cannabis depende da produção controlada de variedades da planta com proporções padronizadas de canabinoides. A extração obedece a procedimentos específicos – feita de modo incorreto, pode até alterar as propriedades da planta.
É provável que a planta total (com seus vários componentes que interagem entre si) tenha efeitos terapêuticos mais eficazes que o uso de um único canabinoide isolado – o que alguns pesquisadores chamam de “efeito entourage”. De acordo com Sidarta Ribeiro, a maconha foi selecionada pelo ser humano através de inúmeras gerações para ser o que é hoje.
“Uma mistura complexa de dezenas de canabinoides que isoladamente chegam até mesmo a ser perigosos para certas pessoas, mas misturados podem ser eficazes e sobretudo seguros.